Nanosystems: Phys. Chem. Math., 2024, 15 (5), 675–682
Proton beam-induced radiosensitizing effect of Ce0.8Gd0.2O2-x nanoparticles against melanoma cells in vitro
DanilD. Kolmanovich – Institute of Theoretical and Experimental Biophysics of the Russian Academy of Sciences, Pushchino, Russia; kdd100996@mail.ru ORCID 0000-0003-3391-7889
Mikhail V. Romanov – Institute of Molecular Theranostics, Sechenov First Moscow State Medical University, Moscow; Lopukhin Federal Research and Clinical Center of Physical-Chemical Medicine of Federal Medical Biological Agency, Moscow, Russia; romanov.mikhail@phystech.edu ORCID 0009-0005-8700-1536
Sergey A. Khaustov – Scientific and Educational Center, State University of Education, Moscow, Russia; sergeykhaustov@gmail.com ORCID 0000-0001-9286-3644
Vladimir K. Ivanov – Kurnakov Institute of General and Inorganic Chemistry of the Russian Academy of Sciences, Moscow, Russia; van@igic.ras.ru ORCID 0000-0003-2343-2140
Alexander E. Shemyakov – Institute of Theoretical and Experimental Biophysics of the Russian Academy of Sciences, Pushchino; Lebedev Physical Institute of the Russian Academy of Sciences, Moscow, Russia; alshemyakov@yandex.ru ORCID 0000-0003-1175-6703
Nikita N. Chukavin – Institute of Theoretical and Experimental Biophysics of the Russian Academy of Sciences, Pushchino; Scientific and Educational Center, State University of Education, Moscow, Russia; chukavinnik@gmail.com ORCID 0000-0001-8431-4485
Anton L. Popov – Institute of Theoretical and Experimental Biophysics of the Russian Academy of Sciences, Pushchino; Scientific and Educational Center, State University of Education, Moscow, Russia; antonpopovleonid@gmail.com ORCID 0000-0003-2643-4846
Corresponding author: A. L. Popov, antonpopovleonid@gmail.com
DOI 10.17586/2220-8054-2024-15-5-675-682
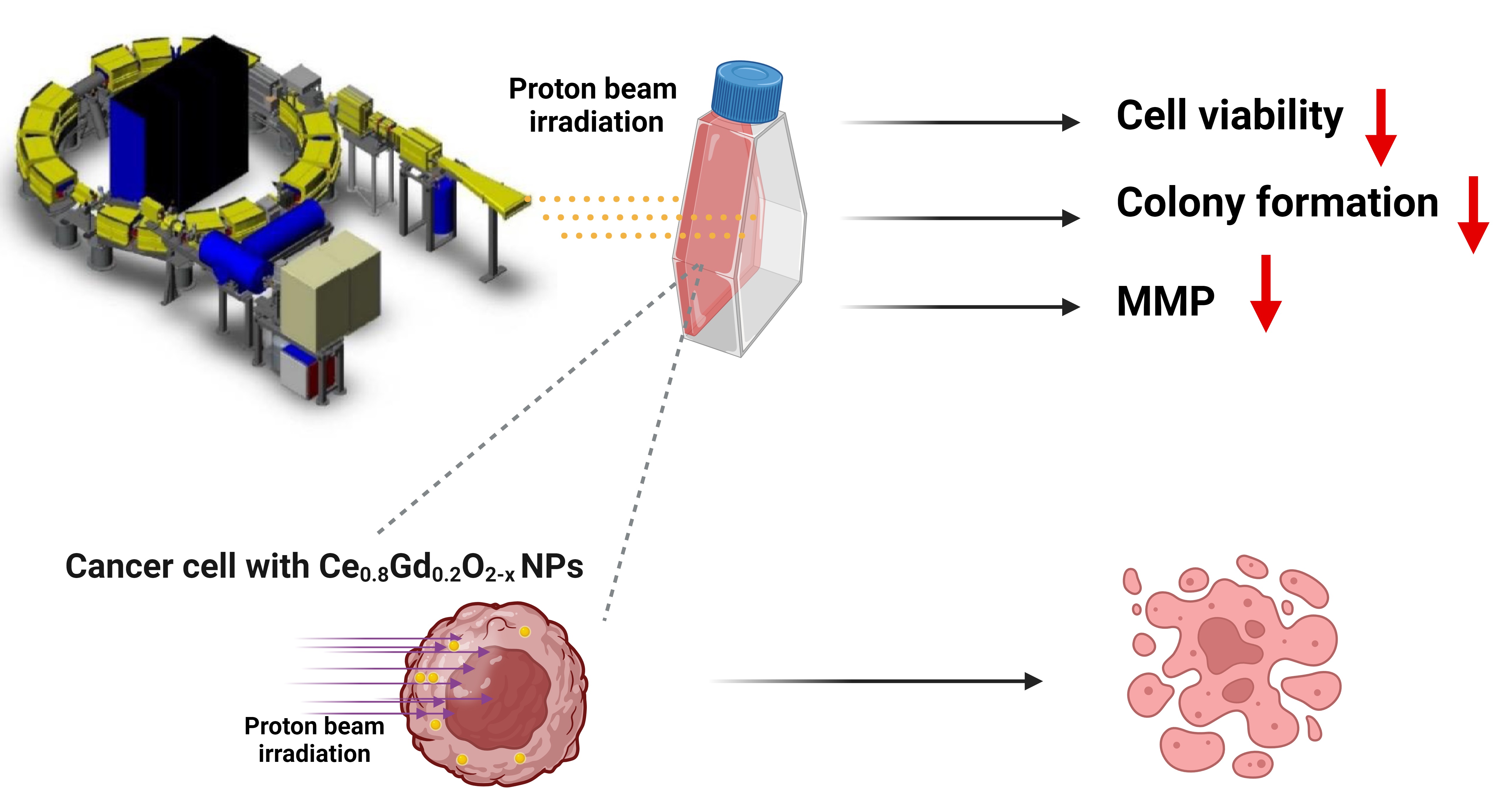
ABSTRACT Proton beam therapy is being used increasingly to treat melanoma. Meanwhile, proton beam therapy has a number of disadvantages that can be reduced or completely eliminated through the use of modern innovative approaches, including the use of nanoradiosensitizers. Here we showed the possibility of using redox-active dextran-stabilized Ce0.8Gd0.2O2-x nanoparticles (Ce0.8Gd0.2O2-x NPs) as a radiosensitizer to promote mouse melanoma cell death under proton beam irradiation in vitro. It has been shown that these Ce0.8Gd0.2O2-x NPs do not reduce the viability and survival rate of both NCTC L929 normal mouse fibroblasts and B16/F10 mouse melanoma cells in a wide range of concentrations. However, Ce0.8Gd0.2O2-x NPs significantly reduce the mitochondrial membrane potential of these cells. Additionally, it has been shown that Ce0.8Gd0.2O2-x NPs are able to effectively reduce the clonogenic activity of B16/F10 melanoma cells under proton beam irradiation. Meanwhile, proton beam irradiation remarkably reduced the clonogenic activity and MMP of melanoma cells. Hence, Ce0.8Gd0.2O2-x NPs act as a radiosensitizer in B16/F10 mouse melanoma cells under proton beam irradiation. We assume that such radiosensitizing effect of Ce0.8Gd0.2O2-x NPs is due to a decrease of the membrane mitochondrial potential. Thus, the use of Ce0.8Gd0.2O2-x NPs in combination with proton beam irradiation is a promising approach for the effective treatment of melanoma.
KEYWORDS gadolinium, cerium oxide nanoparticles, radiosensitization, proton beam irradiation
ACKNOWLEDGEMENTS This research was funded by the Ministry of Science and Higher Education of the Russian Federation (State Assignment: 075-00224-24-03).
FOR CITATION Kolmanovich D.D., Romanov M.V., Khaustov S.A., Ivanov V.K., Shemyakov A.E., Chukavin N.N., Popov A.L. Proton beam-induced radiosensitizing effect of Ce0.8Gd0.2O2-x nanoparticles against melanoma cells in vitro. Nanosystems: Phys. Chem. Math., 2024, 15 (5), 675–682.
[In Russian] Колманович Д.Д., Романов М.В., Хаустов С.А., Иванов В.К., Шемяков А.Е., Чукавин Н.Н., Попов А.Л.
Индуцированный пучком протонов радиосенсибилизирующий эффект наночастиц Ce0.8Gd0.2O2-x в отношении клеток меланомы in vitro
АННОТАЦИЯ Протонно-лучевая терапия все чаще используется для лечения меланомы. Между тем, протонно-лучевая терапия имеет ряд недостатков, которые можно уменьшить или полностью устранить с помощью современных инновационных подходов, включая использование нанорадиосенсибилизаторов. Здесь мы показали возможность использования редокс-активных наночастиц Ce0.8Gd0.2O2-x, стабилизированных декстраном (Ce0.8Gd0.2O2-x НЧ) в качестве радиосенсибилизатора для стимулирования гибели клеток меланомы мыши при облучении пучком протонов in vitro. Было показано, что Ce0.8Gd0.2O2-x НЧ не снижают жизнеспособность и выживаемость как нормальных мышиных фибробластов NCTC L929, так и клеток мышиной меланомы B16/F10 в широком диапазоне концентраций. Однако Ce0.8Gd0.2O2-x НЧ значительно снижают мембранный потенциал митохондрий этих клеток. Кроме того, было показано, что Ce0.8Gd0.2O2-x НЧ способны эффективно снижать клоногенную активность клеток меланомы B16/F10 при облучении пучком протонов. Между тем, облучение протонным пучком значительно снижало клоногенную активность и ММР клеток меланомы. Следовательно, Ce0.8Gd0.2O2-x НЧ действуют как радиосенсибилизатор в клетках меланомы мыши B16/F10 при облучении пучком протонов. Мы предполагаем, что такой радиосенсибилизирующий эффект Ce0.8Gd0.2O2-x НЧ обусловлен гипополяризацией мембран митохондрий. Таким образом, использование Ce0.8Gd0.2O2-x НЧ в сочетании с облучением пучком протонов является перспективным подходом для эффективного лечения меланомы.
КЛЮЧЕВЫЕ СЛОВА гадолиний, наночастицы оксида церия, радиосенсибилизация, облучение протонным пучком